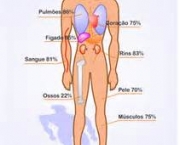
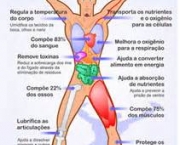
Abrange cerca de setenta por cento do planeta. Traz equilíbrio dinâmico entre o líquido e gás em estados de temperatura e pressão padrão. Substâncias são dissolvidas. Devido a isso, H2O na natureza e na utilização raramente é pura e algumas das suas propriedades podem variar de modo ligeiro em relação aos da substância pura. No entanto, também existem compostos insolúveis. Representa único composto comum encontrado de modo natural nos três comuns estados da matéria. Essencial para a vida na Terra. Abriga entre 55% a 78% do corpo humano.
De acordo com as regras básicas de nomenclatura química, a água teria um nome sistemático de monóxido de hidrogênio, mas isso não está entre os nomes publicados pela União Internacional de Química Pura e Aplicada. Ao invés de ter uso em um contexto químico, o nome se usa quase que de forma humorística para se referir à substância.
Quais as Principais Fases da Água (H2O)?
A líquida está em destaque nos mares e rios. A fase sólida é conhecida como gelo e leva em geral a estrutura de disco rígido, amalgamadas cristais, tais como cubos de gelo, ou acumulados granulares, como cristais de neve. A gasosa se conhece como o vapor, caracterizada por assumir a configuração de nuvem transparente. O quarto estado da água (fluido supercrítico) é menos comuns do que os outros três e ocorre na natureza de modo raro, em condições inabitáveis. Quando atinge determinada temperatura crítica e específica pressão, então passa a fundir à fase fluída homogênea, com propriedades de gás e líquido.
Um exemplo de supercrítica acontece nas partes quentes das profundezas e fontes hidrotermais nas quais se faz aquecida à temperatura crítica por queimaduras vulcânicas e atinge a pressão por causa do peso esmagador do oceano em profundidades extremas em que as aberturas estão localizadas. Além disso, qualquer lugar com atividade vulcânica abaixo de uma profundidade de 2,25 km (1,40 mi) pode ser esperada a ter H2O na fase supercrítica.
De forma primária se pode considera a água como líquido sob as condições normais, o que não é previsto a partir da sua relação com outros hidretos análogos da família de oxigênio na tabela periódica, que são gases, como o sulfureto de hidrogênio, por exemplo. Os elementos adjacentes em oxigênio da tabela periódica combinam com o hidrogênio que produz gases. A razão pela qual a água forma líquido está no oxigênio.
Densidade da Água
A densidade tem de modo aproximado um grama por centímetro cúbico. É dependente da sua temperatura, mas a relação não funciona de forma linear, em vez de monótona. Quando arrefecida a partir de temperatura ambiente, a fase líquida se torna densa, como acontece com outras substâncias, quando a água atinge densidade máxima, a 4°C (39°F). Como ainda está arrefecida se expande por se tornar menos densa. Essa expansão térmica negativa invulgar está atribuída à orientação-dependente, às interações intermoleculares e também observada em fundido de sílica.
Água: Congelamento
Considerando que as ligações de hidrogênio são mais curtas no cristal do que no líquido, esse efeito de bloqueio reduz o número médio de moléculas de coordenação como abordagens de nucleação do líquido. Outras substâncias que se expandem em congelamento são silício, gálio, germânio, antimônio, bismuto, plutônios e também compostos químicos que formam a estrutura de cristal espaçosa com coordenação tetraédrica.
Apenas gelo hexagonal normal é menos denso do que o líquido. Sob uma pressão crescente, o gelo sofre certo número de transições para outras formas alotrópicas com maior densidade do que a fase líquida. O ponto de fusão do gelo fica em 0°C (32 ° F, 273,15 K) à pressão normal, no entanto, a água líquida pura pode ser arrefecida bem abaixo da temperatura de congelação, sem o líquido ser perturbado de forma mecânica.
Pode permanecer no estado de fluido para baixo à homogeneidade de nucleação em ponto de 231 K (-42 ° C). O ponto de fusão do gelo hexagonal normal desce de modo ligeiro sob as pressões altas, mas como gelo se transforma em suas formas alotrópicas, o ponto de fusão aumenta de forma considerável com a pressão.
Aumento significativo da pressão é necessário para baixar o ponto normal de gelo. A água em temperatura de quatro graus célsius sempre se acumula no fundo das zonas com H2O doce, independente da temperatura na atmosfera. Uma vez que a água e gelo são maus condutores de calor (bons isoladores), improvável que o lago seja profundo o suficiente para congelar, a não ser se agite por correntes fortes que misturam água fria e quente ao acelerar o arrefecimento. Em clima para aquecer, pedaços de gelo flutuam, ao invés de afundar até o fundo onde poderiam derreter de forma lenta. Essas propriedades permitem existir vida aquática no lago a sobreviver durante o inverno.
Densidade Superficial da Água
.
A densidade depende do teor de sal dissolvido, bem como a temperatura. Gelo ainda flutua nos oceanos, caso contrário iria congelar a partir de baixo para cima. No entanto, o teor de sal dos oceanos diminui o ponto de congelação em 2°C e reduz a temperatura da densidade máxima para o ponto de congelar. É por isso que, na água do oceano, a convecção descendente fria não se bloqueia por expansão. Água perto do ponto de congelamento continua a afundar.
Por essa razão, qualquer criatura tenta sobreviver na parte inferior da referida água fria. Nos países frios, quando a temperatura da água fresca atinge 4°C, as camadas perto do topo entram em contato com o ar frio que continua a perder a energia de calor. Após arrefecimento abaixo de 4°C, essas camadas não afundam e se levantam a água fresca. Devido a isso, a camada de água a 4°C permanece na parte inferior, acima das camadas de 3°C, 2°C, 1°C e 0°C. Porque o gelo representa condutor de calor ruim, não absorve a energia de calor a partir da água sob a camada de gelo, que impede o congelamento. Assim, criaturas aquáticas sobrevivem em tais lugares.
A água é miscível com diversos líquidos, por exemplo, etanol, em todas as proporções, formando um único líquido homogêneo. Por outro lado, ela e a maioria dos óleos são imiscíveis formadoras de camadas em geral de acordo com o aumento da densidade a partir do topo.
Artigo Escrito por Renato Duarte Plantier
.